迈威生物靶向 Nectin-4 ADC 全球首次公布宫颈癌临床数据,展现优异治疗潜力
上海2024年3月18日 /美通社/ -- 迈威生物 (688062.SH),一家全产业链布局的创新型生物制药公司, 2024 年 3 月 16 日于美国妇科肿瘤学会 (SGO) 年会以聚焦全体会议口头报告 (Focused Plenary Oral Presentation) 形式报告了 9MW2821 宫颈癌临床研究数据。
此次公布的数据展现了其在宫颈癌领域的有效性及良好安全性,有望为复发或转移性宫颈癌的治疗带来新的突破,满足大量未被满足的临床需求。
9MW2821 是全球同靶点药物中首个在宫颈癌适应症报道临床数据的品种。
靶向 Nectin-4 ADC 治疗复发或转移性宫颈癌研究数据报告

该项多中心、开放、I/II 期临床研究由复旦大学附属肿瘤医院张剑教授牵头,本次由复旦大学附属肿瘤医院杨慧娟教授代表研究团队在大会做深入报告。研究结果获得现场专家高度认可。期待获得更进一步的临床研究数据,为复发或转移性宫颈癌患者提供更多治疗选择。
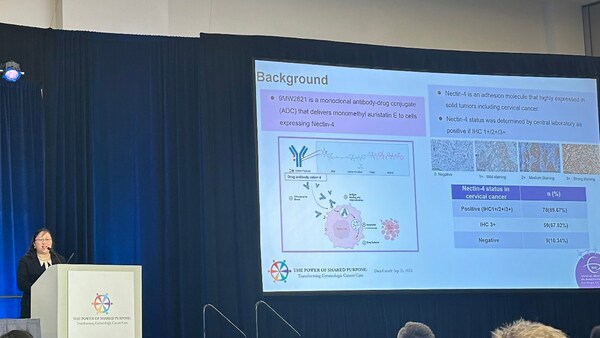
杨慧娟教授现场报告
临床结果
针对复发或转移性宫颈癌的系统性治疗药物选择和治疗效果较为有限。9MW2821 的 I/II 期宫颈癌队列纳入含铂双药化疗联合或不联合贝伐珠单抗失败、系统性治疗方案不超过 2 线的复发或转移性 Nectin-4 阳性宫颈癌患者。受试者在每 28 天为 1 个周期的第 1 天、第 8 天和第 15 天接受静脉输注 1.25mg/kg 的 9MW2821,直到确认疾病进展、死亡、无法忍受的不良反应或退出研究。
截至 2023 年 9 月 25 日,该研究宫颈癌拓展队列中,Nectin-4 表达的检出率为 89.67%,Nectin-4 肿瘤细胞染色强度 3+(以下简称 "Nectin-4 3+")检出率为 67.82%。该研究共入组 40 名患者,57.5% 受试者既往接受过含铂双药化疗联合贝伐单抗治疗, 60% 受试者既往接受过含铂双药化疗及免疫检查点抑制剂治疗。
有效性方面,37 例可评估疗效的患者的 ORR 和 DCR 分别为 40.54% 和 89.19%,其中 1 例完全缓解 (2.70%),14 例部分缓解 (37.84%),中位无疾病进展生存期 (PFS)、总生存期 (OS) 和缓解持续时间 (DOR) 尚未达到。Nectin-4 3+ 的患者中,26 例可评估疗效的患者 ORR 和 DCR 分别为 50.00% 和 92.31%。经过含铂双药化疗及免疫检验点抑制剂治疗的患者中,21 例可评估疗效的患者 ORR 和 DCR 为 38.10% 和 85.71%。
安全性方面,92.50% 的受试者发生了与治疗相关的不良事件,3/4 级治疗相关不良事件中最常见的是中性粒细胞减少症 (40.00%)、皮疹 (17.50%) 和γ-谷氨酰转移酶增加症 (12.50%)。没有与治疗相关的死亡报告。
上述研究结果表明,9MW2821 在宫颈癌患者中具有可控的安全性和积极的治疗效果。